RADIOFREQUENCY ABLATION OF THYROID NODULES
TS BS Trần Thanh Vỹ*, Ths.Bs Lê Quang Đình**
SUMMARY
Radiofrequency (RF) ablation has been gaining popularity as a minimally invasive treatment for benign thyroid nodules regardless of the extent of the solid component. RF ablation of benign nodules demonstrated volume reductions of 33–58% after one month and 51–85% after six months, while solving nodule-related clinical problems. RF ablation has recently shown positive short-term results for locoregional control as well as symptom improvement in patients with recurrent thyroid cancers. This paper reviews the basic physics, indications, patient preparation, devices, procedures, clinical results, and complications of RF ablation.
Giới thiệu
Bướu giáp nhân (bướu cổ) là bệnh lý rất phổ biến ở Việt Nam. Tỷ lệ phát hiện bướu giáp nhân gần đây tăng nhiều nhờ tầm soát bệnh bằng siêu âm vùng cổ.
Theo thống kê của Bộ Y tế (1980-1985), số người mắc bệnh bướu giáp nhân ở miền núi phía Bắc chiếm tỷ lệ 30-40% trong nhân dân, có nơi tới 80%. Ở đồng bằng phía Bắc khoảng 6% người mắc bệnh bướu giáp nhân. Ở đồng bằng sông Cửu Long tỷ lệ người mắc bệnh bướu giáp nhân là 20-30%. Hàng năm có khoảng 115.000 người được khám và chữa bệnh bướu giáp nhân.
Đa phần bướu giáp nhân là lành tính, những bướu giáp nhân cần phải điều trị khi có triệu chứng hoặc do nhu cầu thẩm mỹ [2,3].
Điều trị phẫu thuật bướu giáp nhân có những hạn chế nhất định [4], trong khi liệu pháp hormon vẫn chưa đạt được hiệu quả mong muốn [5].
Theo xu hướng điều trị mới, can thiệp không phẫu thuật hay can thiệp tối thiểu ngày càng được quan tâm, chẳng hạn như điều trị bằng Ethanol, đốt Laser hoặc Sóng cao tần (RFA), cho thấy có hiệu quả tốt trong điều trị nhân giáp [2,6].
Điều trị bướu giáp nhân bằng sóng cao tần được ứng dụng từ năm 2006. Nhiều nghiên cứu gần đây chứng minh RFA là phương pháp an toàn và hiệu quả trong điều trị nhân giáp lành tính và ung thư giáp tái phát [8-10]
Nguyên lý cơ bản của phương pháp điều trị sóng cao tần
Sử dụng sóng cao tần có tác dụng sinh nhiệt khi có dòng điện dao động ở tần số cao trong khoảng 200 đến 1200 kHz [11]. Sóng RF xuyên qua mô, kích thích những ion xung quanh điện cực mô và làm tăng sinh nhiệt (do ma sát) trong tế bào u. Và như vậy, vùng mô bướu bị phá huỷ trong bán kính rất gần (vài mm) quanh điện cực. Thêm vào đó, sự truyền nhiệt từ vùng đốt RF có thể tiếp tục ảnh hưởng từ từ các vùng xung quanh khối bướu. Quá trình gây tổn thương nhiệt thứ phát do ma sát và truyền nhiệt là cơ chế chính của phương pháp điều trị bằng sóng cao tần [11,12].
Ở nhiệt độ trong khoảng 60o – 100oC, gần như mô bị đông cứng ngay lập tức là nguyên nhân không thể phá huỷ mô bướu. Trong khi nhiệt độ lớn hơn 100o – 110o sẽ làm mô bướu bốc hơi và thành carbon, tạo thành lớp cách ly ngăn sự lan nhiệt và vì vậy cũng làm giảm hiệu quả phá huỷ bướu bằng RF [11,13]. Một số nguyên nhân khác làm giảm hiệu quả của RF như: (1) bướu loại hỗn hợp có thành phần sợi hay vôi làm giảm sự truyền nhiệt, (2) mô bướu nằm sát dòng máu có tác động làm mát mô [2].
Chỉ định điều trị
RFA được chỉ định cho một số trường hợp sau [29]:
- Những nhân giáp lành tính có triệu chứng (ví dụ như: có đau vùng cổ, cảm giác khó chịu, khó nói, ho, ảnh hưởng thẩm mỹ hoặc nhân độc tuyến giáp
- Ung thư giáp tái phát tại vị trí đã cắt trọn tuyến giáp cũng như các hạch.
RFA không được khuyến cáo thực hiện cho các ung thư giáp nguyên phát hoặc ung thư dạng túi tuyến vì không có bằng chứng RFA có lợi trong điều trị ung thư giáp [17,29,30].
Chú ý thận trọng khi sử dụng RFA ở phụ nữ có thai, bệnh nhân có vấn đề tim mạch nghiêm trọng và bệnh nhân bị liệt dây thanh đối bên [29].
Theo khuyến cáo năm 2012 của Hiệp hội can thiệp tuyến giáp Hàn quốc [29], cần xác định bản chất bướu giáp lành tính với ít nhất 2 mẫu FNA hoặc sinh thiết lõi dưới hướng dẫn siêu âm [31,32]. Thận trọng trong trường hợp FNA hoặc sinh thiết lõi là lành tính nhưng siêu âm nghi ngờ ung thư [33-36]. Siêu âm có vai trò quan trọng trong đánh giá đặc tính nhân giáp và các cấu trúc giải phẫu xung quanh [1]. Cần đánh giá các đạc tính sau của nhân giáp: ích thước, hình dạng, thành phần đặc hay nang, hồi âm, vôi hoá, máu nuôi, xâm lấn vỏ bao. Đường kích 3 chiều của bướu, đường kính lớn nhất và thể tích nhân được tính bằng công thức: V = πabc/6 (V: thể tích, a: đường kính lớn nhất, b và c : đường kính của 2 đường trực giác còn lại).
Xét nghiệm máu gồm: công thức máu, đông máu, FT3, FT4, TSH, kháng thể kháng giáp và calcitonin. Nếu kết quả xét nghiệm bất thường, nên điều chỉnh các rối loạn trước khi tiến hành đốt RF. Xạ hình giáp giúp phân biệt nhân lạnh và nhân nóng, nhất là những trường hợp có TSH thấp [29].
Trước khi điều trị ung thư giáp tái phát, cần xác định tế bào học bằng FNA dưới siêu âm và đo nồng độ thyroglobulin (Tg). Siêu âm giúp đánh giá kích thước, đặc tính của bướu tái phát cũng như ranh giới với các cấu trúc xung quanh. Chụp CTScan cổ cũng giúp ích trong việc đánh giá bướu tái phát trước khi đốt RF [29].
Thiết bị đốt RF và cách tiến hành
- Thiết bị đốt nhân giáp bằng RF:
Khi những nhân giáp hình êlip và to, hầu hết không có bờ an toàn, trái ngược với u gan, điện cực dùng trong nhân giáp thì cần thiết và được phát triển tại Hàn quốc. Những cải tiến như: tay đốt điện cực thẳng, ngắn (7cm), nhỏ (18 gauge), nhờ đó thao tác dễ dàng và với đầu đốt có nhiều cỡ khác nhau (0.5, 0.7, 1.0 hoặc 1.5cm) sẽ ít làm tổn thương mô giáp lành. Ví dụ: đầu đốt nhỏ (0.5, 0.7cm) dùng đốt RF nhân giáp nhỏ, nhân ung thư tái phát.
Dán miếng điện cực vào da và kết nối với máy RF, rồi nối với tay đốt điện cực. Một bơm nước lạnh (15o – 20oC) dùng đưa nước đến đầu điện cực để ngừa tế bào cháy thành than, nhờ vậy, cải thiện phạm vi tác động của năng lượng RF [22,23].
- Tiến trình đốt nhân giáp bằng RF
Tư thế: BN nằm ngửa, cổ hơi ngửa. Dán miếng điện cực vùng đùi.
Có 2 kỹ thuật : kỹ thuật “xuyên eo giáp” (transisthmic approach method) và “đốt di chuyển” (moving shot technique)
- Kỹ thuật “xuyên eo giáp” [17,22]: điện cực được đưa từ phía đối bên, xuyên qua eo giáp hướng đến nhân giáp. Toàn bộ chiệu dài của điện cực có thể nhìn thấy dưới hướng dẫn siêu âm, và có khoảng an toàn tối thiểu đến tam giác nguy hiểm (bao gồm thần kinh quặt ngược, và thực quản).Vị trí an toàn của điện cực đủ xuyên qua nhu mô tuyến giáp để ngừa dịch đốt nóng bị rò ra ngoài tuyến giáp, và thay đổi vị trí điện cực khi nuốt hoặc khi nói.
- Kỹ thuật “đốt di chuyển” [17,22] được đề xuất bởi Baek và CS., trái ngược với kỹ thuật giữ cố định điện cực dùng trong điều trị u gan. Kỹ thuật giữ cố định điện cực gây nguy hiểm cho những cấu trúc xung quanh do nhân giáp hình ê-líp. Với kỹ thuật đốt di chuyển, nhiều vùng đốt nhỏ liên tiếp bằng cách di chuyển điện cực. Đầu điện cực được đặt ở vị trí ban đầu tại chổ sâu nhất và xa nhất của nhân giáp, sau đó tiến hành đốt phần nhân giáp giật lùi ra nông để tránh bị nhiễu hình do tình trạng sủi bọt khi đốt.
- Nguồn năng lượng RF từ 30 – 120W tuỳ thuộc kích cỡ đầu đốt điện cực và đặc tính nhân giáp. Khởi đầu đốt 30 – 50W, sau đó tăng lên 10W. Nếu không thấy sự thay đổi vùng tăng âm ở đầu điện cực trong 5 – 10s, có thể tăng năng lượng lên tối đa 80 – 120W. Giảm năng lượng RF hoặc tắt hẳn trong vài giây nếu bệnh nhân than đau nhiều, và quá trình đốt hoàn thành khi toàn bộ vùng đốt trở nên tăng âm tạm thời. Lưu ý nên chừa lại tam giác nguy hiểm vì vùng này khá gần thần kinh quặt ngược và thực quản.
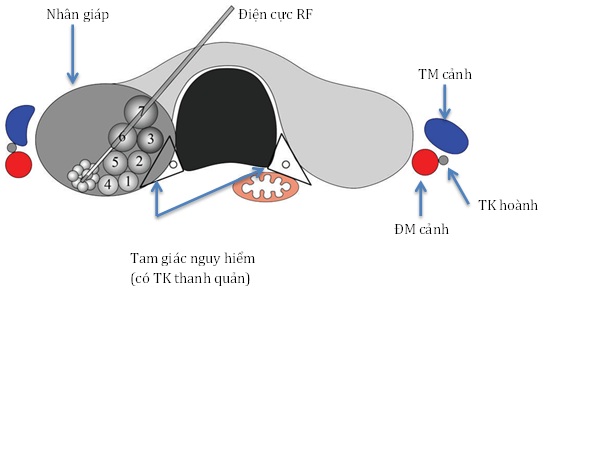
Kỹ thuật “xuyên eo giáp” và “đốt di chuyển”
Kết quả điều trị
- Điều trị nhân giáp lành tính:
Nghiên cứu tiền cứu có nhóm chứng của Baek và CS. [15] đã xác định phương pháp điều trị RF làm giảm thể tích nhân giáp và giảm triệu chứng do nhân giáp gây ra.
Nhiều nghiên cứu xác định phương pháp này giảm thể tích nhân giáp 33 – 58% sau 1 tháng, 51 – 85% sau 6 tháng [15-17,20,22].
Sau đốt RF, thể tích bướu thường giảm nhiều nhất trong tháng đầu. Thể tích bướu tiếp tục giảm từ từ sau đó.
Gần đây, một nghiên cứu trên 111 BN với 126 nhân giáp đã báo cáo thể tích bướu giảm trung bình sau điều trị RF 4 năm là 93.4% [37]
Trong 3 loại bướu giáp với thành phần ưu thế là nang giáp, nhân hỗn hợp hoặc nhân đặc, người ta thấy thể tích bướu giảm sau đốt RF nhiều nhất ở dạng nang trong tháng đầu tiên. Tuy nhiên, theo dõi sau 6 tháng không thấy có sự khác biệt về giảm thể tích ở 3 loại bướu trên.
Điều trị RF hiệu quả với nhân độc tuyến giáp, ngoài việc giảm kích thước nhân, bất thường về chức năng tuyến giáp cũng được cải thiện. Cần cố gắng đốt RF toàn bộ nhân độc giáp, bao gồm cả vùng lân cận, vì phần nhân còn sót lại sẽ tiếp tục gây cường tuyến giáp hoặc nhân giáp lớn trở lại [14,16,20,22].
Mặc dù kỹ thuật đốt di chuyển có thể ngăn ngừa thành công rìa nhân tái phát ở nhiều BN, tái phát sau đốt RF thường ở những vùng lân cận tam giác nguy hiểm hoặc phần sót lại của nhân giáp lớn [2,16,22]. Ví dụ: BN có nhân giáp lớn hơn 20ml có thể phải đốt RF nhiều hơn mới điều trị được hoàn toàn và giải quyết được vấn đề lâm sàng của BN [39].
Chức năng tuyến giáp chỉ ảnh hưởng ít sau đốt RF, mặc dù có một số trường suy giáp được báo cáo với tình trạng tăng kháng thể kháng giáp. Nguyên nhân suy giáp có thể do quá trình viêm giáp tự miễn liên quan với kháng thể đã sẳn có [22,40].
Những BN đã từng được cắt trọn 1 thuỳ giáp thì phương pháp đốt RF giúp bảo tồn chức năng tuyến giáp còn lại, vì vậy có lợi hơn phẫu thuật hoặc điều trị iod phóng xạ với những nhân giáp lành tính có triệu chứng [29].
- Điều trị ung thư giáp tái phát
Với những bệnh nhân ung thư giáp tái phát có nguy cơ phẫu thuật cao hoặc không đồng ý phẫu thuật lại, đốt RF có thể hiệu quả trong việc kiểm soát vùng mô ung thư hoặc cải thiện triệu chứng liên quan đến ung thư [23-26]. Thể tích phần bướu ung thư giáp tái phát sau đốt RF giảm từ 56 – 93%, và tỷ lệ nhân giáp biến mất hoàn toàn từ 42 – 58% [23-25]. Có 64% bệnh nhân cải thiện triệu chứng và nồng độ thyroglobulin giảm [26]. Tuy nhiên, hiện nay vẫn chưa có đầy đủ dữ liệu đánh giá kết quá lâu dài.
Biến chứng
Có nhiều biến chứng có thể xảy ra trong lúc đốt RF, do đó, hiểu rõ những biến chứng và làm đúng kỹ thuật sẽ rất quan trọng giúp điều trị an toàn và hiệu quả [40].
ĐAU: là than phiền thường gặp khi đốt RF, mặc dù đau giảm nhanh khi năng lượng phát ra giảm hoặc tắt. Đau thường tự giới hạn. Vài BN than phiền đau cứng vùng cổ [17].
THAY ĐỔI GIỌNG: là một biến chứng nặng của đốt RF có thể do tổn thương TK quặt ngược thanh quản hoặc chảy máu. Tổn thương TK do nhiệt có thể phòng tránh bằng kỹ thuật đốt di chuyển và chừa phần mô gần kề TK (tránh tam giác nguy hiểm) [15,17,19,22]. Hiểu rõ những thay đổi vị trí của TK hoành, chẳng hạn vị trí sát tuyến giáp cũng giúp ngừa tổn thương TK [3,42].
TỤ MÁU: thường kiểm soát được bằng cách băng ép cổ vài phút. Chảy máu nhiều quanh tuyến giáp có thể ngăn ngừa bằng cách kiểm tra và tránh mạch máu quanh tuyến giáp trước khi đâm xuyên đầu điện cực và lựa loại đầu nhỏ trước [40]. Hầu hết máu bầm sẽ mất hoàn toàn trong 1 đến 2 tuần.
BỎNG DA: thường gặp ở vị trí da đâm xuyên điện cực, nhất là trong trường hợp bướu lớn và phồng ra da. Thay đổi màu sắc da thường phục hồi trong vòng 1 tuần và không để lại di chứng [18,40].
VỠ BƯỚU: biểu hiện với vùng cổ phồng lên đột ngột và đau sau đó. Một nguyên nhân khác là xuất huyết trong nhân [40]. Biến chứng này thường có thể kiểm soát được bằng kháng sinh và kháng viêm.
Triển vọng
Trong tương lai, đốt RF hứa hẹn một là kỹ thuật ít xâm lấn trong điều trị nhân giáp lành tính và ung thư giáp tái phát. Đốt RF cũng có thể dùng trong trường hợp ung thư giáp nguyên phát không thể phẫu thuật được.
Để an toàn và hiệu quả, tiến trình nên được làm dưới siêu âm để thấy rõ vị trí giải phẫu những cấu trúc quan trọng vùng cổ, cũng như nắm vững nguyên lý kỹ thuật và thiết bị dùng đốt RF.
Mặc dù chưa có báo cáo về tổn thương thực quản, khí quản, vấn đề tim mạch do dòng điện RF, hoặc tổn thương do nhiệt những cấu trúc vùng cổ như thần kinh giao cảm cổ và thần kinh sống, bác sĩ thực hiện cần có kiến thức tốt và cẩn trọng trước khả năng có biến chứng, đặc biệt trong những trường hợp bướu tái phát gần những thần kinh vùng cổ.
Để ngăn ngừa tổn thương do nhiệt, người ta tiêm dung dịch làm mát giữa bướu và cấu trúc quan trọng khác như trong điều trị ở gan [43]. Kỹ thuật này cũng hữu dụng khi điều trị ung thư giáp tái phát.
Trong lúc đốt RF nhân giáp, dòng điện RF có thể gây loạn nhịp tim [45]. Để ngăn ngừa biến chứng này, có thể sử dụng đầu đốt lưỡng cực (bipolar electrode), tuy nhiên loại thiết bị này vẫn chưa nghiên cứu dùng cho tuyến giáp.
Kết luận
Điều trị nhân giáp bằng sóng cao tần là một lựa chọn an toàn và hiệu quả, có thể thay thế phẫu thuật cắt bướu giáp bình giáp lành tính, hoặc nhân độc tuyến giáp, cũng như ung thư giáp tái phát. Hiệu quả điều trị có thể đạt được tối đa nếu đốt RF toàn bộ bướu và rìa bướu, giúp ngăn ngừa rìa bướu phát triển trở lại và giảm kích thước nhân giáp. Và để hạn chế biến chứng xảy ra, điều quan trọng là có sự bao quát, nắm vững cấu trúc giải phẫu và nguyên lý của kỹ thuật.
TÀI LIỆU THAM KHẢO
[1] W. J. Moon, J. H. Baek, S. L. Jung et al., “Ultrasonography and the ultrasound-based management of thyroid nodules: consensus statement and recommendations,” Korean Journal of Radiology, vol. 12, no. 1, pp. 1–14, 2011.
[2] J. H. Baek, J. H. Lee, R. Valcavi, C. M. Pacella, H. Rhim, and D. G. Na, “Thermal ablation for benign thyroid nodules: radiofrequency and laser,” Korean Journal of Radiology, vol. 12, no. 5, pp. 525–540, 2011.
[3] E. J. Ha, J. H. Baek, and J. H. Lee, “The efficacy and complications
of radiofrequency ablation of thyroid nodules,” Current Opinion in Endocrinology, Diabetes and Obesity, vol. 18, no. 5, pp. 310–314, 2011.
[4] L. J. Shemen and E. W. Strong, “Complications after total thyroidectomy,” Otolaryngology—Head and Neck Surgery, vol. 101, no. 4, pp. 472–475, 1989.
[5] E. Papini, R. Guglielmi, G. Bizzarri et al., “Treatment of benign cold thyroid nodules: a randomized clinical trial of percutaneous laser ablation versus levothyroxine therapy or follow-up,” Thyroid, vol. 17, no. 3, pp. 229–235, 2007.
[6] Y. J. Kim, J. H. Baek, E. J. Ha et al., “Cystic versus predominantly cystic thyroid nodules: efficacy of ethanol ablation and analysis of related factors,” European Radiology, vol. 22, no. 7, pp. 1573–1578, 2012.
[7] L. Heged¨us, “Therapy: a new nonsurgical therapy option for benign thyroid nodules?” Nature Reviews Endocrinology, vol. 5, no. 9, pp. 476–478, 2009.
[8] R. Diaz, “Thyroid: HIFU for thyroid nodule ablation,” Nature Reviews Endocrinology, vol. 7, article 631, 2011.
[9] O. Esnault, B. Franc, F. M´en´egaux et al., “High-intensity focused ultrasound ablation of thyroid nodules: first human feasibility study,” Thyroid, vol. 21, no. 9, pp. 965–973, 2011.
[10] B. Feng, P. Liang, Z. Cheng et al., “Ultrasound-guided percutaneous microwave ablation of benign thyroid nodules: experimental and clinical studies,” European Journal of Endocrinology, vol. 166, no. 6, pp. 1031–1037, 2012.
[11] H. Rhim, S. N. Goldberg, G. D. Dodd et al., “Essential techniques for successful radio-frequency thermal ablation of malignant hepatic tumors,” Radiographics, vol. 21, pp. S17– S35, 2001.
[12] S. N. Goldberg, “Radiofrequency tumor ablation: principles and techniques,” European Journal of Ultrasound, vol. 13, no.2, pp. 129–147, 2001.
[13] S. N. Goldberg, G. S. Gazelle, and P. R. Mueller, “Thermal ablation therapy for focal malignancy: a unified approach to underlying principles, techniques, and diagnostic imaging guidance,” American Journal of Roentgenology, vol. 174, no. 2, pp. 323–331, 2000.
[14] J. H. Baek, H. J. Jeong, Y. S. Kim, M. S. Kwak, and D. Lee, “Radiofrequency ablation for an autonomously functioning thyroid nodule,” Thyroid, vol. 18, no. 6, pp. 675–676, 2008.
[15] J.H. Baek, Y. S. Kim, D. Lee, J. Y. Huh, and J. H. Lee, “Benign predominantly solid thyroid nodules: prospective study of efficacy of sonographically guided radiofrequency ablation versus control condition,” American Journal of Roentgenology, vol. 194, no. 4, pp. 1137–1142, 2010.
[16] M. Deandrea, P. Limone, E. Basso et al., “US-guided percutaneous radiofrequency thermal ablation for the treatment of solid benign hyperfunctioning or compressive thyroid nodules,” Ultrasound in Medicine and Biology, vol. 34, no. 5, pp. 784–791, 2008.
[17] W. K. Jeong, J. H. Baek, H. Rhim et al., “Radiofrequency ablation of benign thyroid nodules: safety and imaging followup in 236 patients,” European Radiology, vol. 18, no. 6, pp.1244–1250, 2008.
[18] Y. S. Kim, H. Rhim, K. Tae, D. W. Park, and S. T. Kim, “Radiofrequency ablation of benign cold thyroid nodules: initial clinical experience,” Thyroid, vol. 16, no. 4, pp. 361–367, 2006.
[19] J. H. Lee, Y. S. Kim, D. Lee, H. Choi, H. Yoo, and J. H. Baek, “Radiofrequency ablation (RFA) of benign thyroid nodules in patients with incompletely resolved clinical problems after ethanol ablation (EA),” World Journal of Surgery, vol. 34, no. 7, pp. 1488–1493, 2010.
[20] S. Spiezia, R. Garberoglio, F. Milone et al., “Thyroid nodules and related symptoms are stably controlled two years after radiofrequency thermal ablation,” Thyroid, vol. 19, no. 3, pp. 219–225, 2009.
[21] J. Y. Sung, Y. S. Kim, H. Choi, J. H. Lee, and J. H. Baek, “Optimum first-line treatment technique for benign cystic thyroid nodules: ethanol ablation or radiofrequency ablation?” American Journal of Roentgenology, vol. 196, no. 2, pp. W210–W214, 2011.
[22] J. H. Baek, W. J. Moon, Y. S. Kim, J. H. Lee, and D. Lee, “Radiofrequency ablation for the treatment of autonomously functioning thyroid nodules,” World Journal of Surgery, vol. 33, no. 9, pp. 1971–1977, 2009.
[23] J. H. Baek, Y. S. Kim, J. Y. Sung, H. Choi, and J. H. Lee, “Locoregional control of metastatic well-differentiated thyroid cancer by ultrasound-guided radiofrequency ablation,” American Journal of Roentgenology, vol. 197, no. 2, pp. W331–W336, 2011.
[24] D. E. Dupuy, J. M. Monchik, C. Decrea, and L. Pisharodi, “Radiofrequency ablation of regional recurrence from welldifferentiated thyroidmalignancy,” Surgery, vol. 130, no. 6, pp. 971–977, 2001.
[25] J. M. Monchik, G. Donatini, J. Iannuccilli, and D. E. Dupuy, “Radiofrequency ablation and percutaneous ethanol injection treatment for recurrent local and distant well-differentiated thyroid carcinoma,” Annals of Surgery, vol. 244, no. 2, pp. 296– 304, 2006.
[26] K. W. Park, J. H. Shin, B. K. Han, E. Y. Ko, and J. H. Chung, “Inoperable symptomatic recurrent thyroid cancers: preliminary result of radiofrequency ablation,” Annals of Surgical Oncology, vol. 18, no. 9, pp. 2564–2568, 2011.
[27] S. Spiezia, R. Garberoglio, C. Di Somma et al., “Efficacy and safety of radiofrequency thermal ablation in the treatment of thyroid nodules with pressure symptoms in elderly patients,” Journal of the American Geriatrics Society, vol. 55, no. 9, pp. 1478–1479, 2007.
[28] Y. S. Jin, J. H. Baek, S. K. Yoon et al., “One-step ethanol ablation of viscous cystic thyroid nodules,” American Journal of Roentgenology, vol. 191, no. 6, pp. 1730–1733, 2008.
[29] D. G. Na, J. H. Lee, S. L. Jung et al., “Radiofrequency ablation of benign Thyroid nodules and recurrent Thyroid cancers: consensus statement and recommendations,” Korean Journal of Radiology, vol. 13, no. 2, pp. 117–125, 2012.
[30] E. Papini, R. Guglielmi, G.Hosseim et al., “Ultrasound-guided laser ablation of incidental papillary thyroid microcarcinoma: a potential therapeutic approach in patients at surgical risk,” Thyroid, vol. 21, no. 8, pp. 917–920, 2011.
[31] D. G. Na, J.-H. Kim, J. Y. Sung et al., “Core-needle biopsy is more useful than repeat fine-needle aspiration in thyroid nodules read as nondiagnostic or atypia of undetermined significance by the bethesda system for reporting thyroid cytopathology,” Thyroid, vol. 22, no. 5, pp. 468–475, 2012.
[32] J. Y. Sung, D. G. Na, K. S. Kim et al., “Diagnostic accuracy of fine-needle aspiration versus core-needle biopsy for the diagnosis of thyroidmalignancy in a clinical cohort,” European Radiology, vol. 22, no. 7, pp. 1564–1572, 2012.
[33] O. Algin, E. Algin, G. Gokalp et al., “Role of duplex power Doppler ultrasound in differentiation between malignant and benign thyroid nodules,” Korean Journal of Radiology, vol. 11, no. 6, pp. 594–602, 2010.
[34] S. H. Kim, C. S. Park, S. L. Jung et al., “Observer variability and the performance between faculties and residents: US criteria for benign and malignant thyroid nodules,” Korean Journal of Radiology, vol. 11, no. 2, pp. 149–155, 2010.
[35] Y. H. Lee, D. W. Kim, H. S. In et al., “Differentiation between benign and malignant solid thyroid nodules using an US classification system,” Korean Journal of Radiology, vol. 12, no.5, pp. 559–567, 2011.
[36] W. J. Moon, L. J. So, H. L. Jeong et al., “Benign and malignant thyroid nodules: US differentiation—multicenter retrospective study,” Radiology, vol. 247, no. 3, pp. 762–770, 2008.
[37] H. K. Lim, J. H. Lee, E. J. Ha, J. Y. Sung, J. K. Kim, and J. H. Baek, “Radiofrequency ablation of benign nonfunctioning thyroid nodules: 4-year follow-up results in 111 patients,” European Radiology. In press.
[38] S. W. Jang, J. H. Baek, J. K. Kim et al., “How to manage the patients with unsatisfactory results after ethanol ablation for thyroid nodules: role of radiofrequency ablation,” European Journal of Radiology, vol. 81, no. 5, pp. 905–910, 2011.
[39] J. Y. Huh, J. H. Baek, H. Choi, J. K. Kim, and J. H. Lee, “Symptomatic benign thyroid nodules: efficacy of additional radiofrequency ablation treatment session—prospective randomized study,” Radiology, vol. 263, no. 3, pp. 909–916, 2012.
[40] J. H. Baek, J. H. Lee, J. Y. Sung et al., “Complications encountered in the treatment of benign thyroid nodules with us-guided radiofrequency ablation: a multicenter study,” Radiology, vol. 262, no. 1, pp. 335–342, 2012.
[41] R. Valcavi, F. Riganti, A. Bertani, D. Formisano, and C. M. Pacella, “Percutaneous laser ablation of cold benign thyroid nodules: a 3-year follow-up study in 122 patients,” Thyroid, vol. 20, no. 11, pp. 1253–1261, 2010.
[42] F. Giovagnorio and C. Martinoli, “Sonography of the cervical vagus nerve: normal appearance and abnormal findings,” American Journal of Roentgenology, vol. 176, no. 3, pp. 745– 749, 2001.
[43] Y. S. Kim, H. Rhim, D. Choi, and H. K. Lim, “Does artificial ascites induce the heat-sink phenomenon during percutaneous radiofrequency ablation of the hepatic subcapsular area?: an in vivo experimental study using a rabbit model,” Korean Journal of Radiology, vol. 10, no. 1, pp. 43–50, 2009.
[44] D. G. Na, J. H. Lee, S. M. Kim, H. K. Lim, and J. H. Baek, “Unidirectional ablation electrode to minimize thermal injury during radiofrequency ablation: an experimental study in an ex vivo bovine liver model,” Journal of Vascular and Interventional Radiology, vol. 22, no. 7, pp. 935–940, 2011.
[45] S. Mulier, P. Mulier, Y. Ni et al., “Complications of radiofrequency coagulation of liver tumours,” British Journal of Surgery, vol. 89, no. 10, pp. 1206–1222, 2002.
[46] M. L. Jeong, K. H. Joon, H. K. Se et al., “Comparison of wet radiofrequency ablation with dry radiofrequency ablation and radiofrequency ablation using hypertonic saline preinjection: ex vivo bovine liver,” Korean Journal of Radiology, vol. 5, no. 4, pp. 258–265, 2004.
[47] J. Cha, D. Choi, M. W. Lee et al., “Radiofrequency ablation zones in Ex vivo bovine and in vivo porcine livers: comparison of the use of internally cooled electrodes and internally cooled wet electrodes,” CardioVascular and Interventional Radiology, vol. 32, no. 6, pp. 1235–1240, 2009.
[48] D. W. Kim, “Sonography-guided ethanol ablation of a remnant solid component after radio-frequency ablation of benign solid thyroid nodules: a preliminary study,” American Journal of Neuroradiology, vol. 33, no. 6, pp. 1139–1143, 2012.
[49] Y. J. Zhang, H. H. Liang, M. S. Chen et al., “Hepatocellular carcinoma treated with radiofrequency ablation with or without ethanol injection: a prospective randomized trial,” Radiology, vol. 244, no. 2, pp. 599–607, 2007.